Стабилност на комплексните съединения
В разтвори на комплексните съединения на система за динамично равновесие, т.е.. Е. комплексни съединения са обект на голяма степен на електролитна дисоциация. Йони или молекули, присъстващи във външната област, свързани в комплекс е много по-слаби от йони или молекули във вътрешната сфера. Такива видове якост на свързването предизвиква дисоциация на сложната природа на съединенията.
Дисоциация на комплекса се извършва на етапи. В първия етап комплексно съединение се дисоциират като силен електролит, т. Е. почти напълно. Освен това, комплекс йон като слаб електролит дисоциира на етапи, т.е.. Е. разделени чрез комплексиране лиганди постепенно. Например, дисоциация на комплекса сол [Ag (NH3) 2] Cl протича в съответствие със следните стъпки:
Дисоциация на комплекса е само в малка степен и може да се характеризира с величината на общите константи йонизация на комплекса, който се определя като продукт на дисоциационните константи за отделните стъпки. Така, в този пример
Въпреки по-високата стойност на тази константа, по-сложните дисоциира, толкова по-стабилна. Това постоянно се нарича постоянна нестабилност. Реципрочен на константите на нестабилност наречени постоянна стабилност:
нестабилност константа за различни комплексни йони са различни и може да бъде мярка за стабилността на комплекса. Най-стабилен в разтвори на комплексни йони имат най-ниските константи нестабилност. Например, сред съединенията
комплексни съединения
Образование к / поради способността на катионите Me свързани специфични молекули и / или отрицателно заредени йони.
Cu2 ++ 4NH3 = [Cu (NH3) 4] 2+
NH3 + Н + NH4 + →
[] - връзката е силна - donornoaktsektornaya нас
Като част от комплекс йон може да различи йон комплексообразуващ Cu2 +, свързани с молекула лиганди амоняк (лиганди - свързани с йонен / молекула или на otritsatelnozaryazhennye йони) NH3.
Аниони - Neg / заряд йони: ОН, Cl-, Вг-, J-, CNS-, CN-
4 - координира брой [Cu (NH3) m], т.е. к / ч показва броя на лиганди, прикрепени към йон-к / о.
Йон-к / о и вътрешната областта на лиганди образуват от / [...]. Противойоните околните комплекс йон представляват външната сфера. Обвинението на комплекса йон е алгебра сума от таксите на йон-к / O и лиганди. Ако лиганди са аниони, заряда на комплекс йон става отрицателна.
[Cu (CN) 4] 2- CN- * 4 = -4 Cu = + 2 => -2
[Al (OH) 6] 3- - gidroksoalyuminat
Често / час е равно на два пъти степента на йон-до / за окисление. К / могат да се прилагат към различни класове: соли, основи, киселини.
По принцип изграждането на името на / S (nominklatury) запази разпоредбите, които са били приети за нормални връзки, но има свои собствени характеристики. Името на C / S записва своята структура от дясно на ляво, в комплекс името на йон (т.е., че в [...]) последователно се прехвърля в редица лиганди, името на лиганда, името на йон-к / о, и за аниона използва Латинска базирани думи и за катиони - руски език.
[Cu (NH3) 4] 2+ йони tetraaminmedi (II);
NH3-амин; CN-tseano
Ag (NH3) 2] + - сребро диамин йон
[Al (H2O) 6] 3+ - алуминиев йон geksaakva
[Al (OH) 4] - - tetragidroksoalyuminat
[Cu (CN) 4] 2- - tetratsianokuprat (II)
[Al (OH) 6] 3- geksagidroksoalyuminat
[Fe (CN) 6] 3- - geksatsianoferat III
[Fe (CN) 6] 4- geksatsianoferat II
[Cu (NH3) 4] SO4 - тетраамин меден сулфат
К2 [Zn (OH) 4] - tetragidroksotsinkat калиев
К3 [Fe (CN) 6] 3- geksatsianoferat (III) калиев
К4 [Fe (CN) 6] 3- geksatsianoferat (II) калиев
[Cu (NH3) 4] (ОН) 2 - мед II gidroaksidtetraamin
Н2 [TiCl6] - geksahlortitanovaya киселина
K / ч R / ч
Al3 + 4,6 Ag + 2
4 Zn2 + Hg + 2
Fe2 + 4,6 HG2 + 4
Fe3 + 4,6
Един начин за получаване на / S основава на въвеждането на химикал в системата, за да се създаде излишък на съотношение лиганди, съответстваща на броя на координация. Въз основа на тази реакция принцип разтваряне на някои утаяване, включително амфотерни хидроксиди на алкални разтвори.
Zn (OH) 2 (пелети) + 2KOH = К2 [Zn (OH) 4]
Zn (OH) 2 + 2ОН - = [Zn (OH) 4] 2-
AlCl3 + 3KOH = ↓ Al (ОН) 3 + 3KCl
Al (ОН) 3 + КОН = К [Al (OH) 4]
Al (ОН) 3 + 3KOH = K3 [Al (OH) 6]
HgJ2 (oadok) + 2KJ = К2 [HgJ4] -2 - tetraiodogidroargat (II) калиев
HgJ2 + 2J - = [HgJ4] 2-
Комплексни съединения имат много общи свойства на съединенията (например: реакцията обмен, включващ две соли 3FeCl2 + 2K3 [Fe (CN) 6] = Fe3 [Fe (CN) 6] + 6KCL
3Fe2 ++ 2 [Fe (CN) 6] 3- = Fe3 [Fe (CN) 6])
За к / са характерни за специфични реакции, свързани с подмяна на един друг лиганд.
[Cu (H2O) 4] SO4 + 4NH3 = [Cu (NH3) 4] SO4 + 4H2O
[Cu (H2O) 4] 2 ++ 4NH3 = [Cu (NH3) 4] + 4H2O
CN-> NO2-> NH3> CNS-> H2O> ОН-> СГ> Вг> J- *
Възможност да се замени един лиганд, свързан с якост Komlov йони. K / N ж.к. йонни увеличава с силата на лиганд (виж по-горе диапазон *). Лиганди, разположени от лявата страна nazyv силни от дясната страна - слаби (спрямо центъра).
Когато се разтваря във вода / до разделяне тип силни електролити ж.к. йони и противоположно заредени йони на околната среда.
K2Zn (CN) 4] → 2K ++ [Zn (CN) 4] 2-
[Cu (NH3) 4] SO4 → [Cu (NH3) 4] 2 ++ SO42-
В водни разтвори, този процес е почти изцяло (електролит разлагане на йон).
[Zn (CN) 4] 2- ← → Zn2 ++ 4CN- *
За да се характеризира ж.к. йон сила въвежда понятието: нестабилност константи Кн, Кн което представлява дисоциационната на йон COM на *
Кт = (CZn2 + C4CN -) / C [Zn (CN) 4], където С - концентрация, Кн-съдържаща се в наръчници. По-малката стойност на Кн, по-силната принуди активен йон.
Задача 12.
Въз основа на стандартни енталпии на образуване # 916 Н # 730; 298 и абсолютен ентропията S # 730; 298 вещества определят: 1) # 916; Н 730 #; 298 реакция # 916; S # 730; 298 и реакция # 916, Г # 730; 298 отговори. Заключения за термодинамична вероятността за реакция при стандартни условия; 2) температурата, при която че константи равновесие, реакционната е равен на една (# 916; G реакция е добре LU). ефекта на температурата върху # 916 Н и # 916; S незначителна реакция; 3) температура регион, в който потокът на реакцията термодинамично вероятно. Изчисленията на уравнения държат-ями реакции, изброени в таблицата.
Скоростта на химични реакции
А.А. Беляев, VV Загорски, Е.А. Менделеев, DI Менделеев, В. Minaylov,
NI Морозова, А.Е. стенопис
- Скоростта на химична реакция. Определение.
- Влияние на концентрация на скоростта на химична реакция.
- Ефект на натиск върху скоростта на химична реакция.
- Ефект на повърхността на контакт на реагентите в скоростта на химична реакция.
- Влияние на характера на химически реагенти върху скоростта на реакцията.
- Влияние на температурата върху скоростта на химична реакция.
- Катализ и инхибиране.
- допълнителен материал
- експерименти
- задачи
- тест
Опции 1-8. Изчислява се броят на пъти увеличава кал реакциите на скорост-Chem при по-високи температури, когато се прилага в-SG стойност.
Van't Hoff правило - правилото, което позволява първо приближение да се оцени ефекта на температурата върху скоростта на химична реакция в малък температурен диапазон (обикновено от 0 ° С до 100 ° С). JH Van't Hoff на базата на множество експерименти формулирани следното правило:
Когато температурата се повиши на всеки 10 градуса постоянна скорост хомогенна елементарен реакция се увеличава в две - четири пъти.
Уравнението, който описва това правило, както следва:
при което - скоростта на реакцията при температура. - скоростта на реакцията при температура. - коефициент температура (ако е 2, например, скоростта на реакцията ще се увеличи 2 пъти чрез повишаване на температурата от 10 градуса).
Трябва да се помни, че правилото за Van't Hoff е приложима само за реакции с енергия за активиране на 60-120 кДж / мол в температурния обхват от 10-400 ° С член Van't Hoff и не подлежи на реакции, които включват обемисти молекули като протеини в биологична системи. температурната зависимост от скоростта на реакцията за по-точно описва уравнението на Арениус.
От Van't температура коефициент Hoff се изчислява по формулата:
Ускоряване хомогенна реакция - е броят на вещества да взаимодействат или образувани чрез реакцията за единица време за единица обем на системата:
С други думи, хомогенна скоростта на реакция, равна на промяната на моларната концентрация на всеки от реагентите за единица време. Скоростта на реакцията - положителна стойност, така че ако му изразяване чрез промяна на концентрацията на реакционния продукт постави знак "+", а промяната на концентрацията на марката реагент "-".
Добави израз на равновесната константа на обратима реакция, показана в таблицата. Определете какво сто Rhone-измести равновесието на обратими реакции: а) когато розово shenii температура (р = конст); б) когато налягането (Т = конст).
Екзотермична реакция - химическа реакция е придружено от отделяне на топлина. Противоположният ендотермична реакция. Общата сума на енергия в химическа система е изключително трудно да се измери или се брои. От друга страна, промяната на енталпията # 916; Н химическите реакции са много по-лесно да се измери или се брои. За тези цели топломери. измерената стойност # 916 Н е свързан с молекулно свързване енергия, както следва: # 916; H = енергийни прекарани разкъсване връзки (връзка-дисоциация енергия) - Енергията, освободена по време на образуването на връзки на реакционните продукти. Тази формула дава отрицателна стойност за екзотермични реакции за # 916; Н, тъй като по-голямата стойност се изважда от по-малката стойност. При изгарянето на водород, например: 2Н2 + О2 → 2 Н 2О равна на енталпията промяната # 916; H = -483.6 кДж на мол O2.
Ендотермична реакция (от старогръцки. # 7956; # 957; # 948; # 959; # 957; - в и # 952; # 941; # 961; # 956; # 951; - топлинна) - химични реакции, придружени от абсорбция на топлина. За ендотермични реакции, на енталпията промяната на вътрешната енергия и има положителни стойности (.) По този начин, реакционните продукти съдържат повече енергия, отколкото първоначалните компоненти. За ендотермични реакции включват:- редукция на метални оксиди,
- електролиза (абсорбира електрическа енергия)
- електролитна дисоциация (например, разтваряне на солите във вода)
- йонизация
- фотосинтеза.
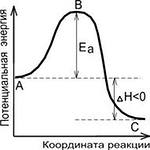
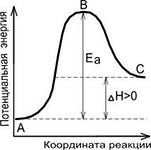
Ефект на Т за промяна на химически равновесие. T с увеличаване Cr намалява за екзотермични реакции и ендотермични увеличава до.
Ефект на стр да смени химически равновесие. ако съотношението на не-равновесни частични налягания (в съответствие с z.d.m.) по-малко Cr. равновесието се измества към образуването на продукти, ако повече Кр. равновесието се измества към образуването на реагентите.
4. равновесие на реакционната 2Н2 (G) + 2 (г) 2Н2 О (д); # 916; Н <0 смещается вправо при:
1) повишаване на температурата; 2) налягането се намалява; 3) увеличаване на налягането?
Всички вещества в системата - газове. В съответствие с принципа на Льо Шателие. повишаване на налягането води до изместване на равновесието на реакцията страна води до по-малко мола газ, т.е. към образуването на Н2 О. Следователно повишаването на налягането в системата измествания реакцията на равновесие надясно. Отговор: При повишаване на налягането.
5. В коя посока ще се измести равновесието на реакционната 2SO2 (ж) + 2 (г) 2SO3 (д); # 916; Н <0 при повышении температуры?
като # 916; Н <0, теплота выделяется в ходе прямой реакции, которая является экзотермической. Обратная реакция будет эндотермической. Повышение температуры всегда благоприятствует протеканию реакции с поглощением теплоты, т.е. равновесие сместится в сторону исходных веществ.
Задача 1. В система A + C, # 916 Н 0 <0, где А, В и С - газы, установилось равновесие. Какое влияние на равновесную концентрацию вещества С окажут: а) увеличение давления; б) увеличение концентрации вещества А; в) повышение температуры?
а) когато поток на реакцията на общия размер на газообразни вещества се намалява от 2 до 1. В съответствие с принципа увеличението на Le Шателие на налягането ще се измести равновесието към по-малкия размер на газообразни вещества (т.е. към образуването на вещество C), следователно, [С] се увеличи.
б) увеличаване на концентрацията на вещество А ще се измести равновесието към образуване на продукт С, т.е. [С] се увеличи.
в) От # 916 Н 0 <0, теплота выделяется, реакция - экзотермическая. Обратная реакция обязательно будет эндотермической. Повышение температуры всегда благоприятствует протеканию реакции с поглощением теплоты, т.е. равновесие сместится в сторону веществ А и В и [С] уменьшится.
Варианти 1-13. Как да променя скоростта на линията и обратната реакция, ако обемът на газовата смес да се повиши (намаление) на п пъти?
Намаляване 4 пъти
1. Колко пъти ще се промени скоростта на реакцията напред N2 (ж) + 3H2 (ж) 2NH3 (г), ако налягането на системата се увеличава на 2 пъти?
Увеличаването на налягането в системата е еквивалентно на 2-кратно намаление в обема на система 2-кратно. По този начин концентрацията на реагентите ще увеличи 2 пъти. Според закона за действието на масите. първоначалната скорост на реакцията е равна на VH = к · [N2] · [Н2] 3. При повишаване на налягането е 2 пъти концентрацията на азот и водород ще се увеличи 2 пъти, и скоростта на реакцията става равна на VK = к · 2 [N2] · 02 март [Н2 ] 3 = к · 32 [N2] · [Н2] 3. VCH връзка. / VH показва как скоростта на промяна на реакцията след промяната на налягането. Следователно, VR / VH = к · 32 [N2] · [Н2] 3 / (к · [N2] · [Н2] 3) = 32. A: Скоростта на реакцията ще се увеличи с 32 пъти.
Изчислява: константа на равновесие на обратима реакция, началната и равновесната концентрация на компонентите в системата (количествата, които се изчисляват в таблицата от х са отбелязани).