Как да се намери броя на протоните и неутроните
Всеки атом съответства вещество елемент от периодичната таблица. Виж елемент на един атом, броят на протоните и неутроните в ядрото да бъде намерен. Определяне на атомното тегло на елемента. Той се намира в долната част на клетката, където химичния елемент. Ако масовото число е представена от частична стойност, тя се закръгля до най-близкото цяло. Този брой е равен на броя на нуклоните в атома. Например, определя атомното тегло на магнезий. Намерете този елемент в периодичната таблица, той има обозначение Mg. Нейната маса номер е 24.305. Кръгла това до цялото и се 24. Това означава, че броят на протоните и неутроните (нуклоните) в ядрото на атом на елемента е 24.
Определя се броя на протоните в ядрото на атома. За да направите това, намерете го в периодичната таблица на химичните елементи. На върха на неговия сериен номер в един ред в клетка в таблицата елемент е маркиран. Това е броят на протоните в ядрото на атом елемент. Например, номер на последователност на магнезий (Mg) е равен на 12. Това означава, че 12 протони, които се съдържат в ядрото.
Понякога единственият известен ядрен заряд в медальона, а след това, да се намери броя на протоните. Разделете този номер от заряда на протон, който е равен на 1,6022 • 10 ^ -19 Кулон. Например, ако е известно, че ядрената заряда на 35.2 • 10 ^ -19 Кулон, а след това да го разделя от 1,6022 • 10 ^ -19 получите номера. приблизително равна на 22. Това означава, че има 2 протоните в ядрото на атома.
След определяне на броя на протоните получите броя на неутроните в ядрата. За тази относителните атомните ядра тегло открити с помощта на периодичната таблица на химичните елементи, изваждане на броя на протоните. намиращ се в ядрото. Тъй като в допълнение към неутронните други тежки частици в ядрото на атом не се съдържа, ще бъде броя на неутроните. Например, за да се намери броя на протоните и неутроните в ядрото на фосфор (Р), тя се намери в периодичната таблица, определяне на масовия номер и серийния номер на елемента. Масовият брой е равен фосфор 30,97376≈31 и серийния номер 15. Това означава, че в ядрото на атома на химичен елемент, съдържаща 15 протона и 16 неутрони = 31-15.
Атомът на химичен елемент се състои от ядро и обвивка електрон. Структурата на атомното ядро се състои от два вида частици - протони и неутрони. Почти цялата маса на атома се концентрира в ядрото, защото протоните и неутроните са много по-тежки от електрони.

- Броят атомната елемент, N-Z диаграма.
Неутроните нямат никаква електрически заряд, т.е. тяхната електрически заряд е нула. Това е основната трудност при определяне на броя на неутроните - атомния номер на елемента или електронния му обвивка не дава еднозначен отговор на този въпрос. Например, в ядро въглероден атом е винаги съдържа 6 протони, протони, но той може да бъде 6 и 7. Вариации ядра химичен елемент с различен брой неутрони в ядрото се наричат изотопи на този елемент. На изотопи могат да бъдат естествени или могат да бъдат получени по изкуствен начин.
Ядрата на атомите означени азбучен символ на химичен елемент от периодичната таблица. В дясно на символа в горната и в долната част има две числа. Горният брой е А - е масовото число на атома. А = Z + N, където Z - ядрен заряд (брой протони), и N - броя на неутроните. Долната броя - е най-Z - отговаря за ядрото. Този запис съдържа информация за броя на неутроните в ядрата. Очевидно е, че е равен на N = A-Z.
Различните изотопи на химичен елемент редица промени, които могат да се видят в записа на този изотоп. Някои изотопи имат оригиналните им имена. Например, обикновен водород ядро не разполага с неутрони и протон. Водородни изотопи деутерий е един неутрони (А = 2, фигура 2 от по-горе, от долу 1), и тритий изотоп - две неутрони (А = 3, фигура 3, по-горе, по-долу 1).
Зависимостта на броя на неутроните от броя на протоните се отразява в така наречения N-Z диаграма на атомните ядра. Стабилност на ядрата зависи от съотношението на броя на неутроните и броя на протоните. Ядра на белия дроб нуклид най-стабилен при N / Z = 1, т.е., с равни количества от неутрони и протони. С увеличаване на броя на масови смени област стабилност на стойностите на N / Z> 1, достигайки стойност на N / Z
1.5 за най-тежки ядра.
Атомите състоят от елементарните частици - протони, неутрони и електрони. Протоните са положително заредени частици, които са в центъра на атома в своята същност. Изчислява се броят на протоните да изотоп на атомен номер на съответния химичен елемент.
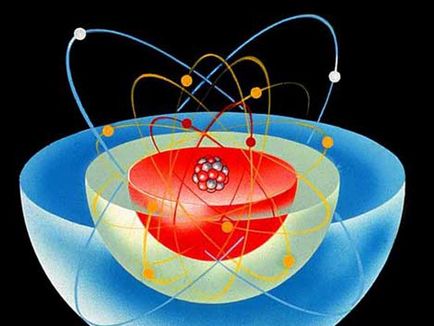
атом модел
За да се опише свойствата на атома и се използва неговата структура модел, известен под името "модел на бор на атом". Според тази структура на атома прилича на слънчевата система - тежка център (ядро) се намира в центъра, и по-леките частици се движат в орбита около него. На неутроните и протоните образуват ядрото на положително заредена, и отрицателно заредени електрони се движат около център, се привлича към него чрез електростатични сили.
Елемент е вещество, състояща се от един вид атоми, се определя от броя на протоните във всяка от тях. Елемент се определя наименованието и символа, например, водород (Н) или кислород (О). химичните свойства на елемент зависят от броя на електрони и съответно броя на протоните, съдържащи се в атомите. Химични характеристики не Atom зависят от броя на неутроните, защото неутроните нямат електричен заряд. Въпреки това, броят им влияе на стабилността на ядрото чрез промяна на общото тегло на атома.
Изотопи и броя на протоните
Изотопи на атоми, се наричат отделни елементи с различен брой неутрони. Тези атоми са химически идентични, но имат различни маси, те също се различават по тяхната способност да излъчват лъчения.
Атомен номер (Z) - е поредния номер на химичния елемент в периодичната таблица, се определя от броя на протоните в ядрото. Всеки атом има атомен номер и номера на маса (А), който е равен на общия брой на протоните и неутроните в ядрото.
Елементът може да има различен брой атоми с неутроните, но броят на протоните остава същата и е равен на броя на електроните на неутрален атом. За да се определи колко протони, които се съдържат в ядрото на изотопа, просто погледнете своя атомен номер. Броят на протоните, равен на броя на съответния химичен елемент в периодичната таблица.
Като пример разглежда водородни изотопи. В природата, най-често от водородни атоми с един протон и не неутрони. В същото време, има изотопите на водорода с един или два неутрона, те са съответните имена. Въпреки това, всички те имат един протон, който съответства на поредния номер на водород в периодичната таблица. водороден изотоп с масово число на неутрони и 2 наречен деутерий или тежка водород, той е стабилен. Тритий е водороден изотоп с масовото число, 3, и двете неутроните, радиоактивни. Понякога се нарича супер тежък водород и тритий ядро - Тритон.
- Радиация Въведение в радиационната защита